原子力显微镜
AFM配件
应用
联系我们
背景与目标:
线粒体,细胞的能量之源,拥有自己独特的DNA基因组。这些基因的缺失变异与神经肌肉疾病和早衰紧密相连。因此,探究线粒体DNA的复制、修复和RNA翻译等机制,对疾病治疗至关重要。这是北卡罗来纳州立大学(North Carolina State University)物理学研究教授Parminder Kaur的研究焦点之一。
线粒体DNA复制过程与所有的双链DNA相似,由解旋酶(helicase)这一大型蛋白复合物启动,如同拉开拉链般将DNA双链分离。在哺乳动物线粒体中,这种解旋酶被称为“Twinkle”。除了有着奇特的名字,Twinkle还奇特于它能在缺乏装载蛋白(loader protein)的情况下与DNA结合,而装载蛋白是细胞核内DNA复制的必要辅助因子。
Kaur教授解释说:“Twinkle是一个锁垫圈形状的六聚体,由六个不同域组成,环状排列,域间链接灵活。我们的任务是利用AFM实时成像技术,研究这个闭合环如何与DNA单链区域结合,并沿双链滑动,加深对线粒体DNA的认知。“

结果与分析:
Kaur教授与Hong Wang教授及莱斯大学的研究人员合作,近期在线粒体DNA复制机制研究上取得里程碑式进展[1]。Kaur教授利用Asylum Research Cypher 系列原子力显微镜得到的图像和视频揭示了这个过程中关键动态数据。
最开始,她在莱斯大学的合作者使用低温电子显微镜(cryo-EM)获得了Twinkle的静态图像。然而,像其他许多多结构域蛋白复合物一样, Twinkle结构复杂且有着多样动态变化,由于涉及到平均过程,冷冻电镜难以准确成像。
为了表征Twinkle的精确结构和动态行为,Kaur教授转而采用兼具高成像质量与视频级扫描速度的Cypher VRS1250。尽管之前有其他研究者已采集过蛋白复合物与膜结合DNA相互作用的AFM数据,但尚未有人能成功在液相环境中观察到六聚体与自由DNA的交互行为。
借助Cypher VRS,团队成功获得每秒1-2张的高分辨率数据。结果也令人震惊:当Twinkle靠近单链DNA时,会发生巨大构象变化,N结构域伸出,如手臂挥动般试图捕获DNA(图1)。尽管Kaur教授团队认为,这个现象是Twinkle是对某种静电力做出的反应,但惊人的是,Twinkle能在超过10nm的距离上感知DNA,并试图接近。结合冷冻电镜数据,这些视频使研究小组得出线粒体DNA复制执行和调节方式的几个重要结论。
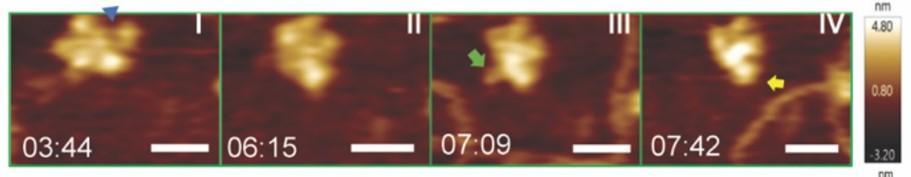
总的来说,通过牛津仪器AFM Cypher VRS在生理环境下的高速成像,解释了线粒体DNA的动态行为,对于理解细胞能量代谢、探索线粒体疾病的发生机制、以及指导抗衰老研究和药物开发具有重要意义。通过深入了解线粒体DNA的变化规律,可以为相关疾病的预防、诊断和治疗提供新的思路和方法。
用户体验:
Kaur教授高度赞扬了牛津仪器 Cypher VRS在研究中的关键作用:“Cypher VRS汇集了三大关键优势:高速采集、液相稳定性和广阔的视野。我们需要以每秒1-2幅图的速度采集数据,以便捕捉DNA结合的瞬间。”她强调,Cypher VRS突破了传统AFM在速度与视野之间的限制。这使得她能够在1μm x 1μm的扫描范围内进行高速成像,并同时追踪多个Twinkle分子,这对于随机观察到至少一个分子捕获DNA的过程至关重要。
Kaur教授还指出了光热(blueDrive)激发在液相扫描中的重要性,因其带来的温和敲击特性和超高探针稳定性。“我在观察水下单个生物分子方面有丰富经验。通常在液相条件下,机械(压电)悬臂梁的固有特性使它们难以产生干净的共振峰,这意味着样品和DNA的运动将被耦合进悬臂梁的振动。而我们在牛津仪器的Cypher上没有这样的限制。即使在1帧/秒的速度下,我们也能清晰地看到DNA在运动,而不会在悬臂的振动中丢失信号。我强烈推荐使用光热激发(blueDrive)在缓冲液环境下进行高速成像,以呈现生物分子,特别是作用中的DNA的生理特性。”
相关应用领域:生物分子(AFM for Biomolecules),细胞和组织(Cell Biology and Tissue Engineering)
引用: Li, Z., Kaur, P., Lo, C.Y., Chopra, N., Smith, J., Wang, H. and Gao, Y., 2022. Structural and dynamic basis of DNA capture and translocation by mitochondrial Twinkle helicase. Nucleic Acids Research, 50(20), pp.11965-11978. https://doi.org/10.1093/nar/gkac1089
点击咨询更多 公安机关备案号31010402003473
公安机关备案号31010402003473